Preparación y propiedades del ácido clorhídrico
El ácido clorhídrico (HCL) resulta un ácido con propiedades corrosivas, que se utiliza mayormente como reactivo de laboratorio. Se le conoce también como ácido muriático, ácido de sal, ácido marino, agua fuerte, salfumán y antiguamente, como espíritu de sal.
Fórmula y preparación del ácido clorhídrico
La fórmula química que conforma a este ácido corrosivo, es HCL. Posee un peso molecular de 36,47 g / mol y se prepara disolviendo cloruro de hidrógeno en agua. El HCL representa una molécula diatómica simple, la cual posee un enlace covalente polarizado, conformado por el átomo de hidrógeno y el átomo de cloro electronegativo.
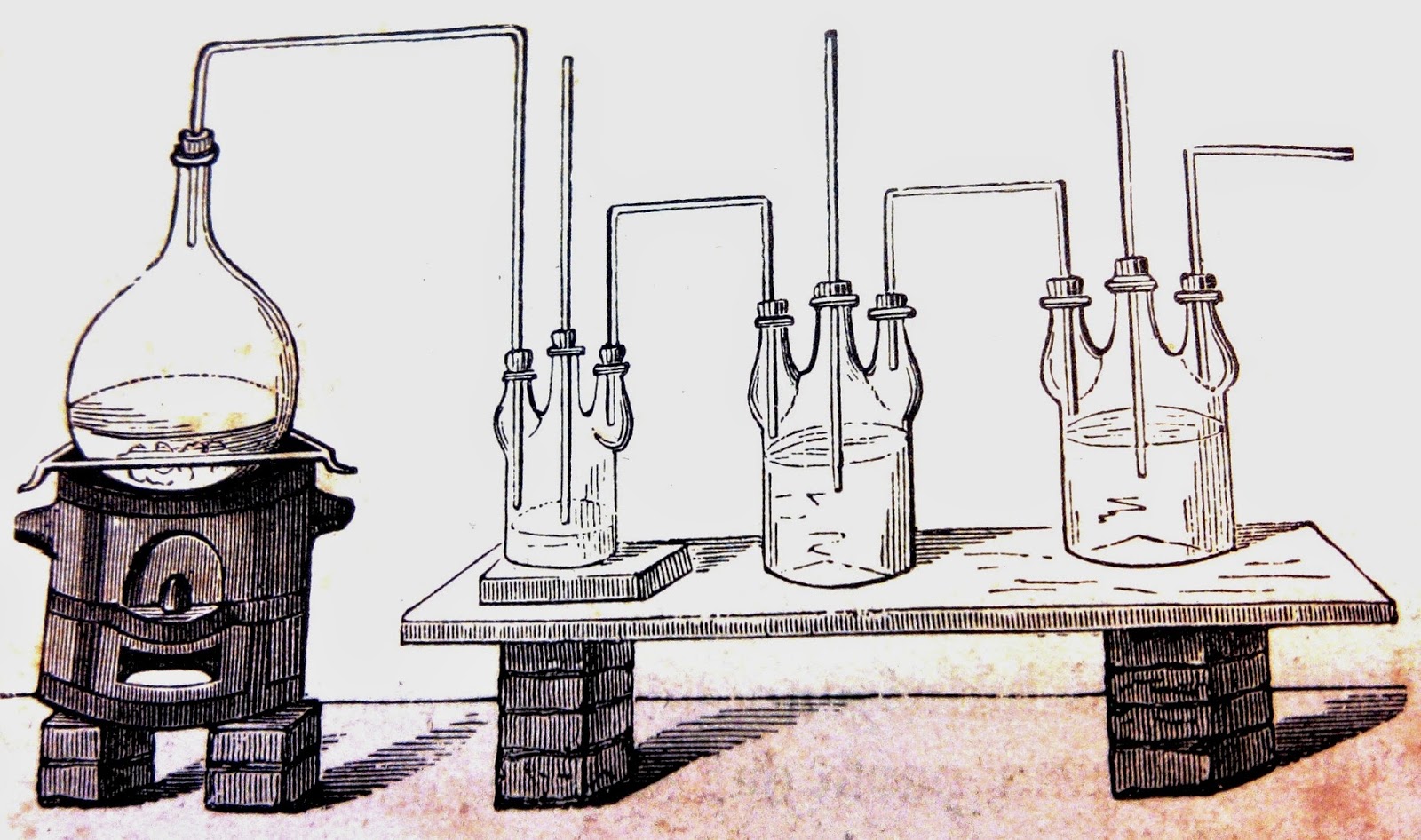
El cloruro de hidrógeno llega a generarse principalmente, gracias a un subproducto de otros productos químicos, aunque también se prepara de manera industrial por medio de la combustión de hidrógeno de cloro. Resulta difícil la preparación de grandes cantidades de ácido clorhídrico debido a que también posee la característica de evaporarse con rapidez.
Propiedades físicas del ácido clorhídrico
Este ácido corrosivo termina siendo una solución de aspecto claro e incoloro, con un olor picante. Sus propiedades físicas varían (punto de ebullición, densidad, punto de fusión) varían debido a la disponibilidad del ácido clorhídrico en sus distintas concentraciones de agua.
Propiedades químicas del ácido clorhídrico
El ácido clorhídrico es el resultado de una mezcla binaria por dos componentes de HCL y H2O. Este es un ácido monoprótico (capaz de donar un protón molecular durante el proceso de disociación) y por lo tanto, sólo es capaz de liberar un ion H+ o protón.
Al contacto con el agua, se disocia completamente, para dar origen a los iones hidronio y cloruro. En grandes concentraciones de HCL, este ácido es capaz de disolver metales.
